1.
SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。
(1)
二氧化硫的水溶液
(2)
①请设计简单实验方案比较室温下  溶液中
溶液中  的电离平衡常数
的电离平衡常数  与水解平衡常数
与水解平衡常数  的相对大小:。
(3)
亚硫酰氯(俗称氯化亚砜,
的相对大小:。
(3)
亚硫酰氯(俗称氯化亚砜,  )是一种液态化合物,沸点
)是一种液态化合物,沸点  ,在农药、制药行业、有机合成等领域用途广泛。
,在农药、制药行业、有机合成等领域用途广泛。  遇水剧烈反应,液面上产生白雾,并伴有刺激性气味的气体产生。蒸干
遇水剧烈反应,液面上产生白雾,并伴有刺激性气味的气体产生。蒸干  溶液不能得到无水
溶液不能得到无水  ,使
,使  与
与  混合加热可得到无水
混合加热可得到无水  ,试解释原因:。
,试解释原因:。
易溶于水,常温常压下溶解度为1:40,溶于水生成
。已知
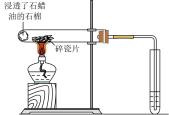
,欲验证酸性:
,设计以下实验达到目的(部分夹持装置已省略)。装置图中
处发生的反应的方程式为,装置
的作用是。能证明
的酸性强于
的实验现象为。

② 时,
的电离常数
,则该温度下
、
的
溶液中
。
【考点】
性质实验方案的设计;
能力提升
真题演练