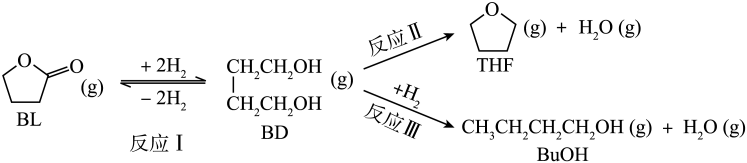
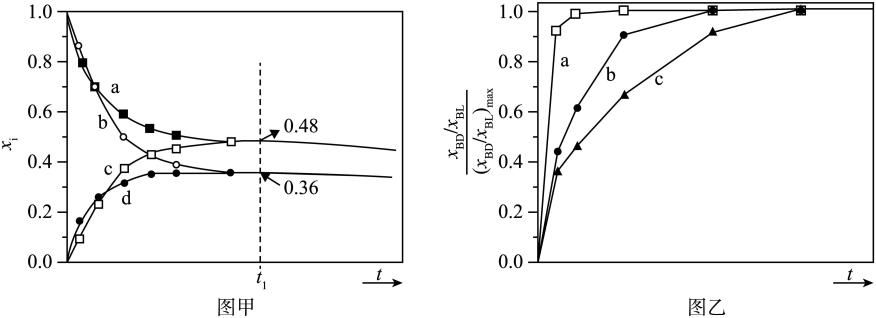
1.
某实验小组测量Fe粉与CuSO4溶液反应的反应热。量取三份100.00mL浓度为0.200mol/L CuSO4溶液和三份质量为1.68g
Fe粉。将Fe粉和CuSO4溶液分别在量热计中混合反应,并测量溶液温度变化,记录数据如下表:
|
反应前溶液温度 |
混合后最高温度 |
|
|
第一次 |
20.2℃ |
30.1℃ |
|
第二次 |
20.3℃ |
30.4℃ |
|
第三次 |
20.4℃ |
29.0℃ |
已知:反应前后,溶液的比热容均近似为4.18J/(g∙℃)、溶液的密度均近似为1.00g/cm3 , 忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)
反应放出的热量Q=J。
(2)
反应Fe(s)+CuSO4(aq)=FeSO4(aq)+Cu(s)的∆HkJ/mol(列式计算)。
【考点】
反应热和焓变;
能力提升
真题演练