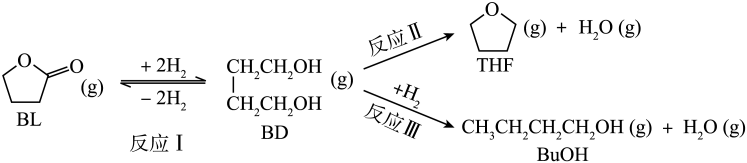
1.
工业上在催化剂作用下可用CO和 合成甲醇,其反应为
合成甲醇,其反应为 , 回答下列问题:
, 回答下列问题:
(1)
已知:反应Ⅰ中的相关的化学键键能数据如下。
(2)
一定条件下向一密闭容器中充入1 mol  和2 mol
和2 mol  , 发生上述反应,CO的平衡转化率与温度、压强的关系如图所示。
(3)
在一恒容密闭容器中发生上述反应,其他条件不变,下列措施可以加快反应速率的是(填序号,下同),能提高CO平衡转化率的是。
, 发生上述反应,CO的平衡转化率与温度、压强的关系如图所示。
(3)
在一恒容密闭容器中发生上述反应,其他条件不变,下列措施可以加快反应速率的是(填序号,下同),能提高CO平衡转化率的是。
化学键 | |||||
键能/(kJ·mol | 1071 | 436 | 358 | 467 | 413 |
由键能可知kJ⋅mol
;该反应(填“自发进行”或“非自发进行”或“高温自发”或“低温自发”)。

①温度;温度为
时,D点反应速率:
。
②A、B、C三点中,正反应速率最大的是(填“A”、“B”或“C”)点,该点对应的平衡常数kPa
(用最简分数表示;
为以分压表示的平衡常数,分压=总压×物质的量分数)
①升高温度 ②将从体系中分离出来
③充入He,使体系总压强增大 ④再充入一定量的
【考点】
反应热和焓变;
能力提升
真题演练