1.
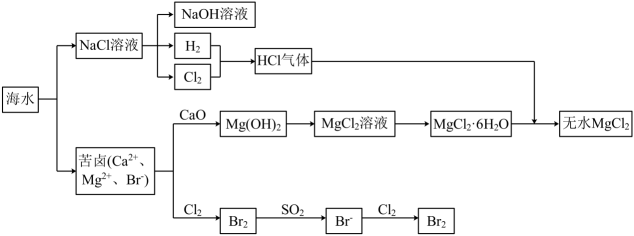
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)
为了使  转化为
转化为  ,试剂①可以选用,要使
,试剂①可以选用,要使  完全转化为沉淀,加入试剂①的量应;
(2)
加入试剂①后,能够分离得到
完全转化为沉淀,加入试剂①的量应;
(2)
加入试剂①后,能够分离得到  沉淀的方法是;
(3)
试剂②可以选用;
(4)
无水
沉淀的方法是;
(3)
试剂②可以选用;
(4)
无水  在熔融状态下,通电后会产生
在熔融状态下,通电后会产生  和
和  ,该反应的化学方程式为:
,该反应的化学方程式为:
。
【考点】
海水资源及其综合利用;
镁、铝的重要化合物;
物质的分离与提纯;
化学实验方案的评价;
能力提升