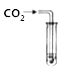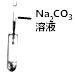1.
某实验小组的同学用氢氧化钠溶液和盐酸做中和反应的实验,当他们向盛有氢氧化钠溶液的烧杯中滴加一定量的稀盐酸后,发现忘记了滴加指示剂.他们停止滴加稀盐酸,对烧杯内溶液中的溶质成分进行探究.
(1)
写出该中和反应的化学方程式:
(2)
探究烧杯内溶液中的溶质的成分.
(3)
【进行实验】
【猜想】猜想一:可能是NaCl和NaOH;猜想二:可能只有NaCl;
猜想三:.
实验步骤 | 实验操作 | 实验现象 | 结论 |
① | 取少量烧杯内的溶液于试管中,滴入几滴酚酞试液,振荡 | 猜想一不成立 | |
② | 取少量烧杯内的溶液于另一支试管中,滴加碳酸钠溶液 | 猜想三成立 |
【考点】
酸的化学性质;
碱的化学性质;
中和反应及其应用;
文字表达式;
能力提升
真题演练