1.
根据下图所示的实验装置,回答下列问题:
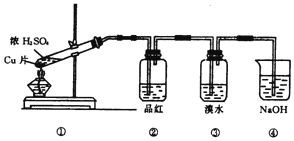
(1)写出铜与浓硫酸反应的化学方程式
(2)证明SO2具有漂白性的现象是 ,再加热该溶液,现象是 .
(3)装置③中的现象是 ,证明SO2具有 .
(4)装置④的作用是 .
(5)若实验后经过处理得到25g CuSO4•5H2O晶体,则被还原的硫酸的质量是 g.
【考点】
二氧化硫的性质;
浓硫酸的性质;


