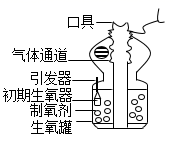
1.
古代铁匠常把烧红的铁器浸入水中急速冷却,以增加铁器的硬度,此法称为“淬火”。某兴趣小组的同学设计了如图所示的实验,用以探究铁与水蒸气在高温条件下反应后的产物(注:夹持仪器已省略)。

【查阅资料1】常温下没有氧气存在时,铁与水几乎不反应,但高温下铁与水蒸气能反应,生成一种固体和一种气体。
(1)
A装置的作用是。
(2)
探究生成的气体是什么?
(3)
【实验验证】如图14所示,加热一段时间后,灰黑色的铁粉逐渐变黑,把导气管放入肥皂水中,吹出的肥皂泡飘到空中,用燃着的木条靠近肥皂泡,听到的爆鸣声,说明产生的气体是。
(4)
探究玻璃管中剩余黑色固体的成分是什么?
(5)
【实验结论】铁与水蒸气发生反应的化学方程式为。
猜测I:氧气; 猜测Ⅱ:二氧化硫; 猜测Ⅲ:氢气
小红认为不需要做实验就可以排除猜测Ⅱ,她的理由是。
同学们讨论后认为:铁与水蒸气在高温条件下反应生成的固体是铁的一种氧化物,玻璃管内的黑色固体中还可能含有剩余的铁。
【查阅资料2】
①铁的氧化物有三种:FeO、Fe2O3、Fe3O4 , 其中仅有Fe2O3为红棕色,FeO、Fe3O4均为黑色,但FeO一接触到空气会立即变成红棕色。
②铁的三种氧化物都不与硫酸铜溶液反应。
【实验探究】
同学们一致认为不需要通过实验探究也可知黑色固体中肯定没有的氧化物是,接着同学们进行了如下实验探究:
实验操作 | 实验现象 | 实验结论 |
①将玻璃管中的黑色固体倒出,平铺于白纸上 | 黑色固体不变色 | 黑色固体中一定没有。 |
②取少许上述黑色固体加入足量的硫酸铜溶液 | 。 | 黑色固体中一定有铁和四氧化三铁 |
【考点】
实验探究物质的性质或变化规律;
实验探究物质的组成成分以及含量;
能力提升
真题演练