1.
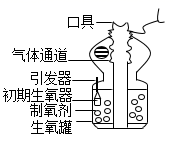
劳动实践课上同学们用草木灰给农作物施肥。他们对草木灰展开了项目式学习的探究之旅。【查阅资料】草木灰是作物秸秆、枯枝等燃烧后剩余的灰烬,富含可溶性钾盐,溶于水显碱性。活动一:调查草木灰的制备方法
(1)
【分析交流】利用秸秆、枯枝等生产草木灰,其优点是(写一条)
(2)
活动二:探究草木灰成分
(3)
【反思评价】步骤①中的稀盐酸(填“能”或“不能”)用稀硫酸代替,原因是。
(4)
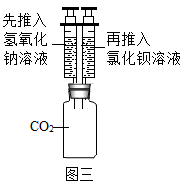
小东将步骤①和②中滴加的试剂互换,也得到了上述结论,则他向试管中滴加稀盐酸时观察到的现象是
(5)
活动三:讨论使用草木灰的注意事项
(6)
【拓展应用】古代曾以硝土(含硝酸钙)和草木灰为原料制取硝酸钾,其反应的化学方程式为。
【猜想与假设】草木灰中可能含有碳酸钾、硫酸钾中的一种或两种。
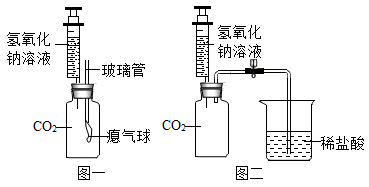
【进行实验】
同学们取一定量草木灰于烧杯中,加入足量水浸泡,过滤,得到滤液。
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴 加足量稀盐酸 | 草木灰中含有碳酸钾和硫酸钾 | |
②向步骤①反应后的溶液中滴加足量溶液 | 产生白色沉淀 |
草木灰(填“能”或“不能”)与铵态氮肥混合施用。
【考点】
实验探究物质的性质或变化规律;
实验探究物质的组成成分以及含量;
能力提升
真题演练