1.
分离提纯是化学实验中的重要部分。环己醇中加入浓硫酸后适当加热脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:

可能用到的有关数据如下:
|
| 密度/(g•cm-3) | 沸点/℃ | 溶解性 |
| 环己醇 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 0.8102 | 83 | 难溶于水 |
反应结束后,将粗产物倒入分液漏斗中,分别用碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,得到环己烯 ,回答下列问题:
(1)
仪器a的名称是 冷凝管的进水口是 ,(填“b”或“c”)温度计的位置应该在
(2)
在本实验分离过程中,产物应该从分液漏斗的 (填 “上口倒出 ”或“下口倒出”)
(3)
分离提纯过程中加入无水氯化钙的目的是 .
【考点】
蒸馏与分馏;
能力提升
真题演练








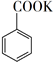 + MnO2
+ MnO2  +HCl→
+HCl→  +KCl
+KCl