1.
学好化学能使我们更好地认识各种现象,更合理地解决实际问题,更轻松地应对生活中可能出现的突发事件。
下图是探究铁制品锈蚀的条件时做的五个实验(铁钉在不同环境中),实验一段时间后,发现甲、乙、戊中铁钉生锈快慢的顺序为,通过这五个实验可以得出的结论是:。
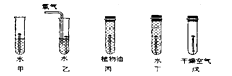
【考点】
探究金属锈蚀的条件;
变式训练
拓展培优
真题演练







 甲:头发被带电的气球吸引,说明头发原来一定带电
甲:头发被带电的气球吸引,说明头发原来一定带电 乙:两个铅柱没有被重物拉开,说明分子之间存在引力
乙:两个铅柱没有被重物拉开,说明分子之间存在引力 丙:一段时间后,只有①中铁钉生锈,说明铁生锈与水有关
丙:一段时间后,只有①中铁钉生锈,说明铁生锈与水有关 丁:干冷的烧杯内壁有水珠生成,说明蜡烛中含有氢元素
丁:干冷的烧杯内壁有水珠生成,说明蜡烛中含有氢元素