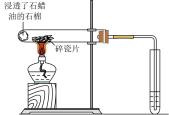
1.
利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。

下列说法错误的是( )
A.
上述正极反应均为O2+4e-+2H2O=4OH-
B.
在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C.
向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D.
在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
【考点】
铁的吸氧腐蚀;