1.
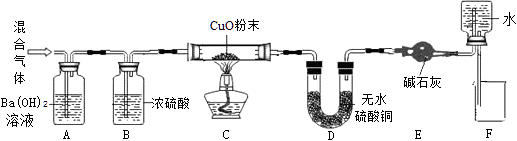
兴趣小组同学用氧化铜与足量的炭粉利用图甲所示的装置进行实验,对生成气体的成分 进行探究。

【提出问题】生成的气体中是否含有一氧化碳?
【实验与讨论】①打开 K,缓缓通入干燥的氮气一段时间。通入氮气的目的是。
②关闭 K,加热至一定温度使之反应,用气囊收集气体样品。
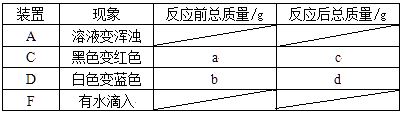
③除去气体样品中的二氧化碳,并将剩余气体收集在集气瓶中,下列装置中最为合理的是。
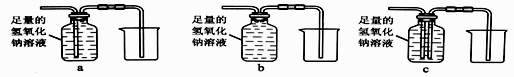
【实验求证】将除尽二氧化碳后的气体样品干燥,仍然用图甲所示的装置进行实验,若 A 中的固体选用 CuO,B 中溶液为澄清石灰水,若出现现象,可说明气体样品中含有一氧化碳。
【考点】
金属、金属氧化物、碱之间的转化;