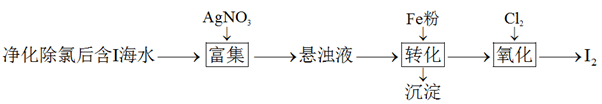
1.
某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强,数值越小,还原性越强。
测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
物质 |
|
|
| NaBr | KI | |||
浓度 | 5% | 5% | ||||||
电位值/mV | 276 | 683 | 671 | 1130 | 603 | 362 | 116 | -361 |
根据表中数据,回答下列问题:
(1)
浓度均为 的下列三种溶液,氧化性由强到弱的顺序为(填序号)。
(2)
影响物质氧化性强弱的因素有、。
(3)
已知
的下列三种溶液,氧化性由强到弱的顺序为(填序号)。
(2)
影响物质氧化性强弱的因素有、。
(3)
已知 与
与 不能共存,由此推测下列一定不能大量共存的离子组是。
(4)
向
不能共存,由此推测下列一定不能大量共存的离子组是。
(4)
向 溶液滴加少量酸性
溶液滴加少量酸性 溶液,补充完成下列离子方程式:
(5)
往淀粉一KI溶液中逐滴加入氯水,观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。
溶液,补充完成下列离子方程式:
(5)
往淀粉一KI溶液中逐滴加入氯水,观察到溶液先变蓝后褪色。小组同学就溶液褪色的原因,提出两种猜想,并设计如下实验进行验证。
① ②酸性
③酸性
a.、
b.
、
c.
、
、
_______。
猜想1:_____。
猜想2:被氯水继续氧化
查阅资料:不能漂白淀粉与
结合形成的蓝色物质。
序号 | 实验操作 | 试剂 | 现象 | 结论 |
1 | 分别取少量褪色的溶液于三支试管中,并加入对应试剂,观察实验现象 | a | _____ | 猜想1不正确 |
2 | 淀粉溶液 | 溶液不变蓝 | 猜想2正确( | |
3 | b+稀 | 溶液变蓝 |
①猜想1为,实验1所用试剂a为,实验1的现象为。
②该反应的离子方程式为
【考点】
氧化性、还原性强弱的比较;
氧化还原反应方程式的配平;
能力提升
真题演练