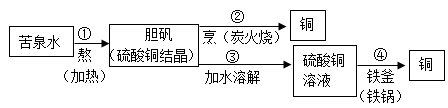
1.
推理是学习化学的一种方法。以下推理正确的是( )
A.
碱溶液显碱性,则显碱性的溶液一定是碱溶液
B.
pH<7的溶液呈酸性,则pH<X的雨水是酸雨
C.
单质只含一种元素,则只含一种元素的物质一定是单质
D.
复分解反应只是两种化合物相互交换成分,则复分解反应一定没有元素化合价的改变
【考点】
复分解反应及其应用;