1.
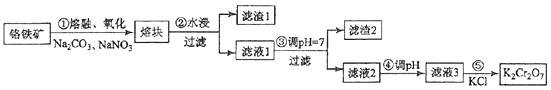
某磁性材料(Fe/Fe3O4)广泛应用于磁记录、催化等领域。一种制备该材料的流程如下:

已知反应原理为:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
(1)
用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为。
(2)
当pH<2时,Fe/Fe3O4产率极低的原因是。
(3)
图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。回流1h所得产品Fe/Fe3O4中产生杂质可能的原因。
(4)
采用Pd-Fe3O4双催化剂,可实现用H2消除酸性废水中的NO 和NO
和NO , 反应历程如图3所示。
, 反应历程如图3所示。


其中Fe3O4中Fe2+和Fe3+分别用Fe(II)、Fe(III)表示。
①用该法处理废水后,溶液的pH。(填“降低”“升高”或“不变”)
②写出过程④反应的离子方程式。
③反应历程中虚线方框内NO生成N2的过程可描述为。
【考点】
氧化还原反应方程式的配平;
制备实验方案的设计;
能力提升
真题演练