1.
硫化锂 广泛地应用于电池行业。实验室可用多种方法制备
广泛地应用于电池行业。实验室可用多种方法制备 。回答下列问题:
。回答下列问题:
(1)
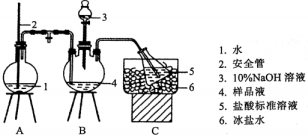
以碳酸锂粉末与 在
在 条件下制备
条件下制备 , 实验装置如图所示(夹持仪器已省略):
(2)
研究表明,高温下,
, 实验装置如图所示(夹持仪器已省略):
(2)
研究表明,高温下, 与焦炭反应也可以制备
与焦炭反应也可以制备 。有同学认为气体产物中可能含有
。有同学认为气体产物中可能含有 、
、 及
及 , 为验证气体成分,选用下图所示的部分装置(可以重复选用)进行实验。
(3)
测定产品
, 为验证气体成分,选用下图所示的部分装置(可以重复选用)进行实验。
(3)
测定产品 的纯度。取产品ag于锥形瓶中,加入
的纯度。取产品ag于锥形瓶中,加入 硫酸(足量),充分反应后排尽产生的气体,滴入2滴酚酞,用
硫酸(足量),充分反应后排尽产生的气体,滴入2滴酚酞,用
 标准溶液进行滴定,达到滴定终点时,消耗
标准溶液进行滴定,达到滴定终点时,消耗 标准溶液的体积为
标准溶液的体积为 。
。

1.溶液 2.
溶液 3.磁子 4.加热炉 5.反应管 6.石墨舟 7.
溶液
①仪器X的名称为,写出X中发生反应的离子方程式:[已知:]。
②能否用稀硝酸代替溶液?(填“能”或“不能”),简述理由:(语言叙述)。
③石墨舟中反应生成的化学方程式为。

①实验装置连接的合理顺序为:。
气体产物______
_____
。
②若F中品红溶液未褪色,H中黑色粉末变为红色,G前的C中澄清石灰水不变浑浊,H后的C中澄清石灰水变浑浊,则与焦炭反应的化学方程式为。
①达到滴定终点的现象是。
②产品中的质量分数为。
【考点】
中和滴定;
探究物质的组成或测量物质的含量;
能力提升
真题演练