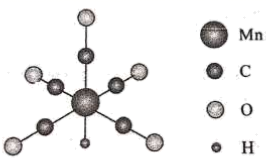
1.
四氯化钛( )主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取
)主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取 , 反应的化学方程式为
, 反应的化学方程式为
 。请回答下列问题:
。请回答下列问题:
(1)
基态钛原子的电子排布式为,其未成对电子数为。
(2)
已知:H、 、
、 的电负性分别为2.1、3.0、1.5,则
的电负性分别为2.1、3.0、1.5,则 中
中 和
和 之间的化学键类型为,
之间的化学键类型为, 中
中 的化合价为。
(3)
基态碳原子中,能量最高的电子位于轨道,该轨道有个伸展方向,轨道形状为。
(4)
若用
的化合价为。
(3)
基态碳原子中,能量最高的电子位于轨道,该轨道有个伸展方向,轨道形状为。
(4)
若用 表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
(5)
基态铁原子的外围电子轨道表示式为。
表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
(5)
基态铁原子的外围电子轨道表示式为。 的稳定性强于
的稳定性强于 , 从微观角度解释其原因为。
, 从微观角度解释其原因为。

与
的差值明显大于其他相邻电离能的差值,原因是。
【考点】
原子核外电子排布;
元素电离能、电负性的含义及应用;
能力提升
真题演练