1.
[选修3:物质结构与性质]
很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
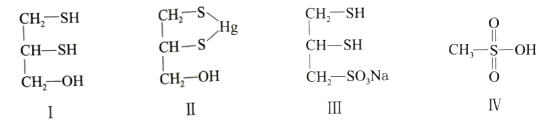
(1)
基态硫原子价电子排布式为。
(2)
H2S、CH4、H2O的沸点由高到低顺序为。
(3)
汞的原子序数为80,位于元素周期表第周期第ⅡB族。
(4)
化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________。
A.
在I中S原子采取sp3杂化
B.
在Ⅱ中S元素的电负性最大
C.
在Ⅲ中C-C-C键角是180°
D.
在Ⅲ中存在离子键与共价键
E.
在Ⅳ中硫氧键的键能均相等
(5)
汞解毒剂的水溶性好,有利于体内
重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是。
(6)
理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。

①图9b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是。
②图9c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为;该晶胞中粒子个数比Hg:Ge:Sb = 。
③设X的最简式的式量为Mr , 则X晶体的密度为g/cm3(列出算式)。
【考点】
原子核外电子排布;
元素电离能、电负性的含义及应用;
晶体熔沸点的比较;
晶胞的计算;
原子轨道杂化方式及杂化类型判断;
能力提升
