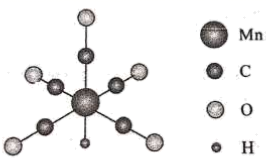
1.
原子是肉眼和一般仪器都看不到的微粒,科学家们是根据可观察、可测量的宏观实验事实,经过分析和推理,揭示了原子结构的奥秘。
(1)
下列说法中正确的个数是__________。
(2)
下列Li原子电子排布图表示的状态中,能量最低和最高的分别为、。
(3)
研究发现,正离子的颜色与未成对电子数有关,例如: 、
、 、
、 等。
等。 呈无色,其原因是(从微粒结构的角度进行描述)。
(4)
钠在火焰上灼烧产生的黄光是一种原子光谱(选填“发射”或“吸收”)。
(5)
第四周期的元素形成的化合物在生产生活中有着重要的用途。
(6)
随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。表中列出了第三周期的几种元素的部分性质:
呈无色,其原因是(从微粒结构的角度进行描述)。
(4)
钠在火焰上灼烧产生的黄光是一种原子光谱(选填“发射”或“吸收”)。
(5)
第四周期的元素形成的化合物在生产生活中有着重要的用途。
(6)
随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。表中列出了第三周期的几种元素的部分性质:
①同一原子中,s电子的能量总是低于p电子的能量
②任何s轨道形状均是球形,只是能层不同,球的半径大小不同而己
③2p、3p、4p能级的轨道数依次增多
④原子核外电子排布,先排满K层再排L层,排满M层再排N层
⑤基态碳原子的轨道表示式:
⑥ⅢB族到ⅡB族的10个纵列的元素都是金属元素
⑦用电子式表示的形成过程:
![]()
⑧基态钒原子的结构示意图为
A.![]() B.
B.
C. ![]() D.
D.
①镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为,按照电子排布式,镍元素在周期表中位于区。
②“玉兔二号”月球车通过砷化镓太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为形。砷的电负性比镓(填“大”或“小”)。
元素编号 | a | b | c | d | e |
电负性 | 3.0 | 2.5 | x | 1.5 | 0.9 |
主要化合价 |
|
|
|
①预测x值的区间:~。
②表中五种元素的第一电离能由大到小的顺序是(写元素符号)。
【考点】
原子核外电子排布;
元素电离能、电负性的含义及应用;
能力提升
真题演练