1.
为了有效减少碳排放,我们可利用CO2制备“合成气”(CO、H2)、甲醇、二甲醚等产品,进行资源化应用,利用CO2合成二甲醚有两种工艺。
工艺一:涉及以下主要反应:
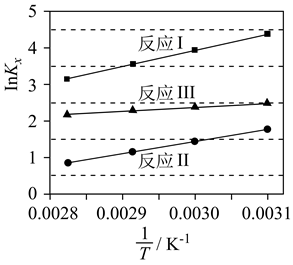
Ⅰ.甲醇的合成:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H1<0;
Ⅱ.逆水汽变换:CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H2>0;
Ⅲ.甲醇脱水:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H3>0。
工艺二:利用CO2直接加氢合成CH3OCH3(反应Ⅳ)。
(1)
①反应Ⅳ的热化学方程式:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ∆H4=。(用上述反应的∆H表示)。
(2)
工艺一需先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CH3OH的平衡产率随温度的变化关系如甲图所示,CO2的平衡转化率随温度的变化关系如乙图所示。
(3)
对于反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H2>0,反应速率υ=υ正—υ逆=k正p(CO2)p(H2)—k逆p(CO)p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
(4)
利用电化学装置可实现将 和
和 两种分子转化为常见化工原料,瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池示意图如图所示:
两种分子转化为常见化工原料,瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池示意图如图所示:
②恒温恒容条件下,下列说法能判断反应Ⅳ达到平衡的是(填字母)。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内压强不变
C.容器内气体密度不变
D.混合气体的平均摩尔质量不变

①下列说法正确的是。
A.P1>P2>P3
B.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压条件
C.一定温度、压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是。
①升高温度,k正—k逆(填“增大”“减小”或“不变”)。
②在T1、刚性容器条件下,按照n(CO2):n(H2)=1:1投料,Kc= , 反应达到平衡时CO2转化率为。
③在T2、101kPa条件下,按照n(CO2):n(H2)=1:1投料,CO2转化率为20%时,=
, 用气体分压表示的平衡常数Kp=。

①电极1发生的电极反应为
②电池工作一段时间后停止,溶液pH值(变大,变小,不变)。
【考点】
化学平衡常数;
化学平衡转化过程中的变化曲线;
能力提升
真题演练






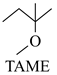 △H1
△H1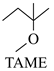 △H2
△H2