1.
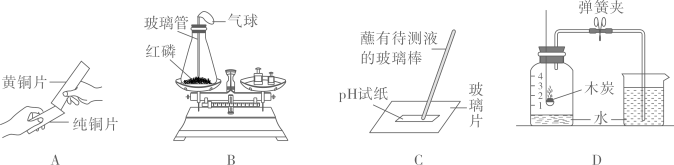
化学是一门以实验为基础的科学,如下图所示的实验回答问题:

(1)
图A是验证质量守恒定律的实验,实验时红磷 (选填“需要”或“不需要”) 过量。
(2)
为达到验证量守恒定律的目的,小林更换了B实验中的药品,以下改进正确的是(填序号)。
(3)
为达到验证质量守恒定律的目的,小郭只更换了B实验的装置,如图2所示,此装置中气球没有体现的作用是(填序号)。
(4)
由质量守恒定律可知,化学反应前后一定不变的是(填序号)。
①将药品换成双氧水和二氧化锰
②将药品换成铁粉和硫酸铜溶液
③将药品换成白糖和蒸馏水
①控制气体的总量
②盛放、添加固体药品
③调节装置的压强
④调节装置的容积
①原子种类 ②原子数目 ③原子质量 ④分子种类
【考点】
验证质量守恒定律;
能力提升
真题演练






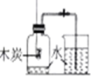 测定空气中氧气的含量
测定空气中氧气的含量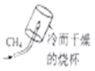 探究甲烷中是否含碳元素
探究甲烷中是否含碳元素 验证质量守恒定律
验证质量守恒定律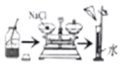 配制一定溶质质量分数的氯化钠溶液
配制一定溶质质量分数的氯化钠溶液