1.
化学反应伴随着能量变化,根据所学知识,回答下列问题:
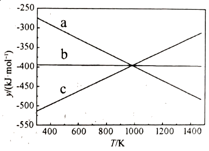
(1)
化学反应 的能量变化如图所示。试写出
的能量变化如图所示。试写出 和
和 反应生成
反应生成 的热化学方程式。
(2)
卤化镁高温分解的相对能量变化如图所示。
(3)
手持技术测定中和反应反应热的装置和测定结果如图。实验中一次性快速注入
的热化学方程式。
(2)
卤化镁高温分解的相对能量变化如图所示。
(3)
手持技术测定中和反应反应热的装置和测定结果如图。实验中一次性快速注入 溶液。下列相关说法正确的是
溶液。下列相关说法正确的是


①写出该温度下分解的热化学方程式:。
②比较热稳定性:(填“>”或“<”)
。
③反应
。

①实验中碱稍过量的原因为。
②磁子表面的聚四氟乙烯(填“能”或“不能”)换成铁,原因是。
③测定稀盐酸和稀氢氧化钠中和热(中和热为)的实验装置如图所示(
溶液稍微过量)。实验数值结果小于
, 原因可能是(填字母)。
A.将盐酸换成同体积、同浓度的醋酸 B.读取混合液的最高温度记为终点温度
C.用量筒量取盐酸时仰视读数 D.分多次把溶液注入盛盐酸的烧杯中
【考点】
热化学方程式;
盖斯定律及其应用;
能力提升
真题演练