1.
下列有关说法正确的有
①需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀
②酸性氧化物都是非金属氧化物
③盐在水溶液中一定电离出金属阳离子和酸根阴离子
④碱性氧化物都是金属氧化物
⑤纯净物只由一种元素组成,而混合物由两种或两种以上元素组成
⑥只由一种元素的阳离子和另一种元素的阴离子组成的物质一定是纯净物
⑦电离产生H+的化合物不一定是酸
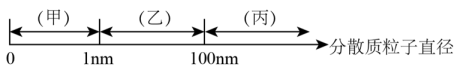
⑧碘晶体分散到酒精中、淀粉溶于水中所形成的分散系分别为:溶液、胶体
⑨两种盐反应一定生成两种新盐
⑩沸水中滴加少量饱和FeCl3溶液形成带电的胶体,导电能力增强
A.
1个
B.
2个
C.
3个
D.
4个
【考点】
物质的简单分类;
分散系、胶体与溶液的概念及关系;
胶体的性质和应用;


 B.
B.  C.
C.
 B.
B.  C.
C.