1.
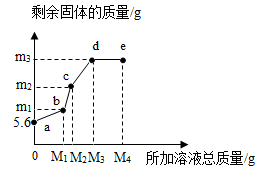
氧化物、酸、碱、盐相互之间的关系是初中科学中重要学习内容之一。现有如图所示的转换关系:

(1)请写出下列物质的化学式B。
(2)与A溶液反应的实验现象为。
【考点】
盐的性质及用途;
基础巩固
能力提升
变式训练
拓展培优
真题演练