1.
乙醇是重要的化工原料。实验室利用乙醇可以制备乙烯,工业上还可利用乙醇催化氧化制备乙醛。
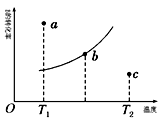
Ⅰ.在催化剂Cat1、Cat2作用下,利用乙醇制备乙烯: , 在恒容密闭容器中充入足量乙醇,发生上述反应,测得单位时间内乙醇的转化率与温度、催化剂的关系如图1所示。

(1)催化剂效能较高的是(填“Catl”或“Cat2”),判断依据是相同温度下,该催化剂作用下,单位时间内乙醇转化率较(填“高”或“低”)。
(2)在催化剂Catl作用下,温度低于400℃时,升温,活化分子百分数(填“增大”或“减小”),反应速率增大,单位时间内乙醇的转化率增大。温度高于400℃时,转化率b→c段变化的原因可能是。
(3)b点(填“已达到”或“未达到”)平衡状态,判断依据是。
Ⅱ.乙醇催化氧化制备乙醛。某温度下,乙醇制备乙醛的反应:。测得平衡时乙醇转化率、乙醛选择性、乙醛产率与
的关系如图2所示。提示:乙醛选择性
, 乙醛的产率=乙醇转化率×乙醛选择性。
(4)投料比时,随着投料比增大,乙醛产率增大的原因可能是;投料比
时,随着投料比增大,乙醛产率减小的主要原因可能是。
(5)一定温度下,向某密闭容器中投入5molCH3CH2OH,达到平衡时测得转化率为80%,CH3CHO选择性75%,则生成CH3CHO的物质的量为。
【考点】
化学平衡转化过程中的变化曲线;
能力提升
变式训练
拓展培优
真题演练