1.
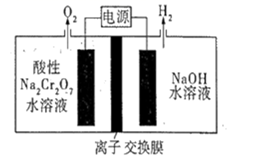
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。请按要求回答相关问题:

(1)甲装置电池负极发生的电极反应式是:
(2)乙中X是(阴、阳)离子交换膜,向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,请用化学用语解释相关原因
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为
(4)若丙装置中a、b电极均为Cu,则丙中发生的离子反应是
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解的原理如图所示

Ag-Pt电极上的电极反应式为
【考点】
电解池工作原理及应用;
能力提升
变式训练
拓展培优
真题演练


 )的工作原理如图所示。
)的工作原理如图所示。