1.
电化学原理在海水资源综合利用及污染治理方面有着重要的作用。
(1)
电解饱和食盐水的原理如图所示。
(2)
煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示,利用电极反应将 转化为
转化为 ,
,  再将煤中的含硫物质(主要成分是
再将煤中的含硫物质(主要成分是 )氧化为
)氧化为 和
和 , 即
, 即 。
。

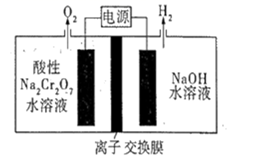
①电解饱和食盐水的离子方程式是。
②电极a接电源的(填“正”或“负”)极。
③离子交换膜主要允许(填离子符号)通过。
④解释装置右侧出口得到较浓NaOH溶液的原因:。
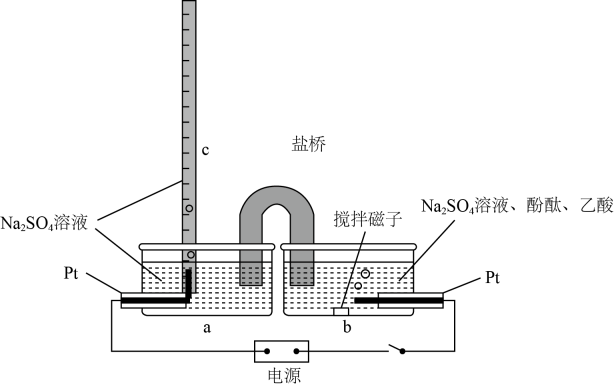
已知:两电极为完全相同的惰性电极。

①电极上的电极反应式为。
②电解池工作时,观察到电极上有无色气体产生,写出电极反应式:。
当转移电子的物质的量为时,则生成的无色气体在标准状况下的体积为L。
③电解池工作时,往(填“
”或“
”)极移动,一段时间后,混合液中
的物质的量(填“变大”“变小”或“不变”)。
【考点】
电解池工作原理及应用;
能力提升
真题演练


 )的工作原理如图所示。
)的工作原理如图所示。