1.
下列有关实验内容、实验装置和对应的实验目的均错误的是
|
|
A.证明 | B.用该装置和秒表测氢气的生成速率 |
|
|
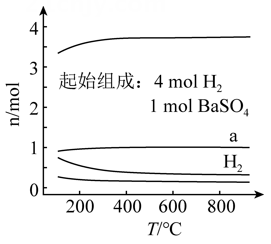
C.验证反应是吸热还是放热 | D.证明温度对平衡移动的影响 |
A.
A
B.
B
C.
C
D.
D
【考点】
吸热反应和放热反应;
基础巩固
能力提升
变式训练
拓展培优
真题演练