1.
二氧化碳的回收利用是环保和能源领域研究的热点课题,回答下列问题:
已知:反应i.
反应ii.
(1)
常温下,用氨水吸收 可获得
可获得 溶液。
(2)
反应iii.
溶液。
(2)
反应iii. , 则
, 则 ( (用含
( (用含 和
和 的代数式表示),
的代数式表示), (用含
(用含 和
和 的代数式表示)。
(3)
一定条件下,在
的代数式表示)。
(3)
一定条件下,在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 , 发生主反应
, 发生主反应 和副反应
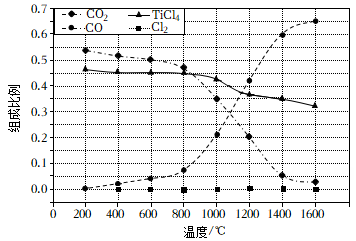
和副反应 。测得温度对
。测得温度对 、
、 平衡产率的影响如下图所示。
平衡产率的影响如下图所示。
①该反应的化学方程式为。
②反应的平衡常数表达式为
。

①(填“>”或“<”)0。
②反应达到平衡后,保持温度和体积不变,向密闭容器中充入少量的稀有气体,则(填“增大”“减小”或“不变”),副反应的化学平衡(填“向正反应方向”“向逆反应方向”或“不”)移动。
③时,反应达到平衡,此时测得
的物质的量为
、
的物质的量为
, 则副反应的
。
【考点】
盖斯定律及其应用;
化学平衡常数;
能力提升
真题演练





 (g) ∆H1<0
(g) ∆H1<0 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
