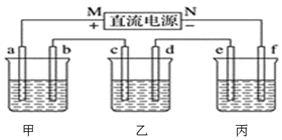
1.
根据所学化学知识,回答下列问题。
I.太阳能可以给我们提供能源,现在以太阳能为热源,经铁氧化物循环分解液态水的过程如图所示。

已知:①2H2(g)+O2(g)=2H2O(g)
②
(1)请写出过程I的热化学方程式
II.为了实现碳达峰、碳中和,工业利用合成乙烯,反应原理为:
(2)已知温度对 的平衡转化率和催化效率的影响如图:
的平衡转化率和催化效率的影响如图:

①由图可知:该反应为反应(填“放热”或“吸热”)。M、N两点对应的平衡常数:(填“>”“<”或“=”)。
②在总压为的恒压条件下,M点的投料比为n(H2):n(CO2)=3:1,达到平衡时乙烯的体积分数为。用平衡分压代替平衡浓度可以得到平衡常数
, 则M点对应温度下的
(只需列出有具体数字的计算式,不要求计算出结果)。
③结合图像分析,工业上将该反应温度定于250℃的原因:
(3)已知反应的正反应速率可表示为 , 逆反应速率可表示为
, 逆反应速率可表示为 , 其中
, 其中 、
、 为速率常数。如图中能够代表
为速率常数。如图中能够代表 的曲线为(填“
的曲线为(填“ ”“
”“ ”“
”“ ”或“
”或“ ”)。
”)。

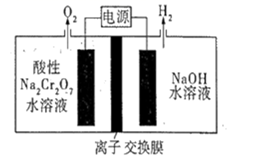
(4)利用惰性电极电解 同样可以制得乙烯,原理如图:
同样可以制得乙烯,原理如图:

b极的电极反应式为
【考点】
电解池工作原理及应用;
能力提升
变式训练
拓展培优
真题演练