在双碳目标驱动下,氢源的获取和利用成为科学研究的热点之一、回答下列问题:
Ⅰ.氢源的获取:电解液氨制氢、利用天然气制氢
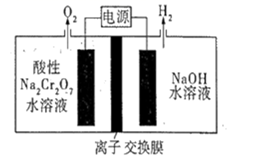
(1)以液氨为原料,使用Pt电极及NaNH2非水电解质电解制氢(已知电解液中含氮微粒只有NH3、和
)。产生H2的电极反应式为。
(2)已知反应1:CH4(g)+H2O(g)3H2(g)+CO(g) ΔH1=+206 kJ·mol-1
反应2:CO(g)+H2O(g)H2(g)+CO2(g) ΔH2=-41 kJ·mol-1
①反应CH4(g)+2H2O(g)4H2(g) +CO2(g)的活化能E正-E逆=。实际生产中常将温度控制在600~900 ℃,从反应的角度分析温度不能过高的主要原因可能是。
②一定温度下,向1 L的刚性容器中充入1 mol CH4和w mol水蒸气发生上述反应1和反应2,达到平衡时,测得有x mol CO、y mol CO2和相应的H2生成,此时容器内的压强为p Pa(假设没有其他反应发生)。在该条件下,CH4的平衡转化率为%,反应1的平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。
③据图甲所示,600 ℃时,随着水碳比的增大,平衡体系中H2的体积分数增大的原因是。若600 ℃达到平衡时,其他条件不变,再增大压强,n(H2)(填“变大”“变小”或“不变”)。

Ⅱ.氢源的利用:利用氢气制备甲醇和甲酸
(3)不同催化剂下,用CO2和H2制备甲醇,相同时间内CO2的转化率与温度的变化如图乙所示,催化效果最好的是催化剂(填“Ⅰ”“Ⅱ”或“Ⅲ”)。

(4)CO2加氢可制备HCOOH:CO2(g)+H2(g)HCOOH(g) ΔH=-31.4 kJ·mol-1。实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),将一定量CO2和H2充入固定体积为1 L的密闭容器中发生反应。温度为T1 ℃时,平衡常数K=0.8,则k逆=k正;温度为T2 ℃时,k正=1.2k逆 , 则T2 ℃时平衡压强(填“>”“<”或“=”)T1 ℃时平衡压强。