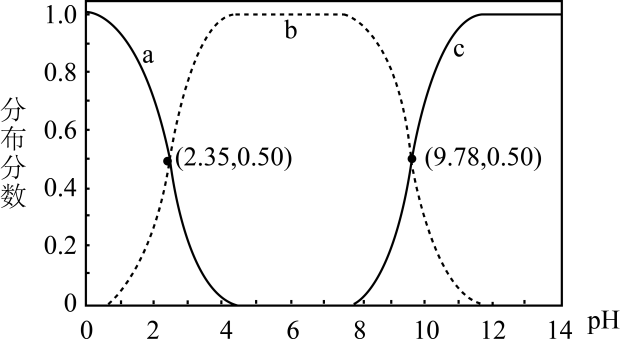
1.
常温下,在 (弱酸)溶液中滴加
(弱酸)溶液中滴加 (弱碱)溶液生成强电解质
(弱碱)溶液生成强电解质 , 混合溶液中
, 混合溶液中 与
与 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是

A.
 代表
代表 与
与 的关系
B.
的关系
B.
 时达到
时达到 点,
点, 不水解
C.
常温下,
不水解
C.
常温下, D.
D.
 的平衡常数
的平衡常数 小于10000
小于10000
【考点】
电离平衡常数;
能力提升
变式训练
拓展培优
真题演练