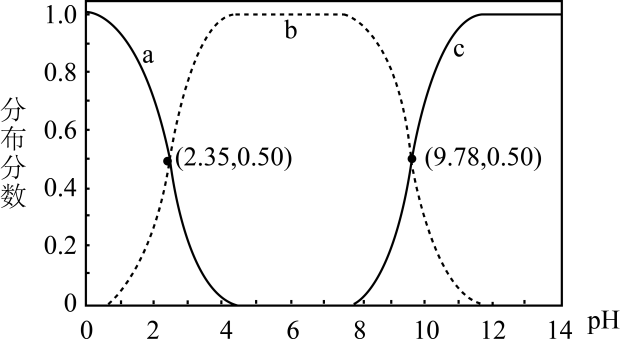
1.
已知:25℃时,相关酸(或碱)的电离平衡常数如下表所示:
酸 | ||||||
电离常数(K) |
请回答下列问题:
(1)
25℃时, 溶液的
溶液的 , 溶液中的
, 溶液中的
 ,
,  溶液的
溶液的 , 由水电离出的
, 由水电离出的
 ,
,  溶液呈碱性的原因:(用离子方程式解释)。
(2)
向
溶液呈碱性的原因:(用离子方程式解释)。
(2)
向 溶液中加蒸馏水稀释到1L后,下列说法不正确的是(填序号)。
(3)
“84消毒液”中滴加白醋,可增强溶液的漂白性,原因:(用离子方程式解释)。
(4)
结合表中数据分析,25℃时,
溶液中加蒸馏水稀释到1L后,下列说法不正确的是(填序号)。
(3)
“84消毒液”中滴加白醋,可增强溶液的漂白性,原因:(用离子方程式解释)。
(4)
结合表中数据分析,25℃时, 的①
的① ②
② ③
③ 三种溶液的pH由大到小的顺序是:(填写序号)。
(5)
已知
三种溶液的pH由大到小的顺序是:(填写序号)。
(5)
已知 溶液呈酸性,请结合离子方程式解释其呈酸性的原因:。
(6)
溶液呈酸性,请结合离子方程式解释其呈酸性的原因:。
(6)
 的电离方程式为;25℃时,向氨水中加入稀硫酸至溶液的
的电离方程式为;25℃时,向氨水中加入稀硫酸至溶液的 , 此时溶液中
, 此时溶液中 , 则
, 则
 。
。
a.的电离程度增大 b.
增大
c.减小 d.
减小
【考点】
离子浓度大小的比较;
能力提升
真题演练