1.
回答下列问题:
(1)
氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(2)
由 羟基丁酸(
羟基丁酸( )生成
)生成 丁内酯(
丁内酯( )的反应如下:
)的反应如下:

 。在25℃时,溶液中
。在25℃时,溶液中 羟基丁酸的初始浓度为0.180mol/L,随着反应的进行,测得
羟基丁酸的初始浓度为0.180mol/L,随着反应的进行,测得 丁内酯浓度随时间的变化如下表所示。
丁内酯浓度随时间的变化如下表所示。
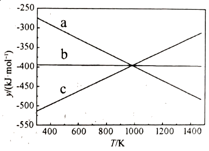
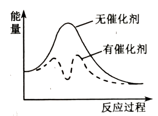
①利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH=-1807.98kJ·mol-1 , 下列能表示该反应中能量变化的是(填字母)。
A. B.
B. C.
C.
②利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol-1
H2O(l)=H2O(g) ΔH=+44kJ·mol-1
则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=,1.6gCH4还原NO2生成N2和液态水时放出的热量为kJ。
t/min | 21 | 50 | 80 | 100 | 120 | 160 | 220 | |
c(mol/L) | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
请填写下列空白:
①在50~80min内,以丁内酯的浓度变化表示的反应速率为。
在100min时,羟基丁酸的转化率为。
②在25℃时,该反应的平衡常数为K=。
③为提高平衡时羟基丁酸的转化率,除适当控制反应温度外,还可采取的措施是。
【考点】
热化学方程式;
能力提升
真题演练