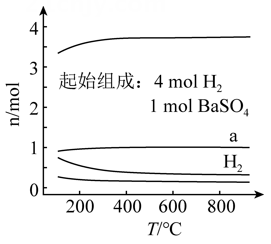
1.
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)
该反应的逆反应为热反应,且m+np(填“>”、“=”“<”)。
(2)
减压时,A的质量分数(填“增大”“减小”或“不变”)。
(3)
若加入B(体积不变),则A的转化率(填“增大”“减小”或“不变”)。
(4)
若升高温度,则平衡时B、C的浓度之比 将(填“增大”“减小”或“不变”)。
(5)
若加入催化剂,平衡时气体混合物的总物质的量(填“增大”“减小”或“不变”)。
(6)
若B是有色物质,AC均无色,则加入C(体积不变)时混合物颜色(填“变深”、“变浅”或“不变”);而维持容器内压强不变,充入氖气时,混合物颜色(填“变深”、“变浅”或“不变”)。
将(填“增大”“减小”或“不变”)。
(5)
若加入催化剂,平衡时气体混合物的总物质的量(填“增大”“减小”或“不变”)。
(6)
若B是有色物质,AC均无色,则加入C(体积不变)时混合物颜色(填“变深”、“变浅”或“不变”);而维持容器内压强不变,充入氖气时,混合物颜色(填“变深”、“变浅”或“不变”)。
【考点】
化学平衡的影响因素;
化学平衡移动原理;
能力提升
真题演练