1.
市售的溴(纯度 )中含有少量的
)中含有少量的 和
和 , 某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
, 某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
(1)
装置如图(夹持装置等略),将市售的溴滴入盛有浓 溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为;
溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为; 溶液的作用为;D中发生的主要反应的化学方程式为。
(2)
将D中溶液转移至(填仪器名称)中,边加热边向其中滴加酸化的
溶液的作用为;D中发生的主要反应的化学方程式为。
(2)
将D中溶液转移至(填仪器名称)中,边加热边向其中滴加酸化的 溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成
溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成 的离子方程式为。
(3)
利用图示相同装置,将R和
的离子方程式为。
(3)
利用图示相同装置,将R和 固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓
固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓 , 水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为和。
(4)
为保证溴的纯度,步骤(3)中
, 水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为和。
(4)
为保证溴的纯度,步骤(3)中 固体的用量按理论所需量的
固体的用量按理论所需量的 计算,若固体R质量为m克(以
计算,若固体R质量为m克(以 计),则需称取
计),则需称取 (用含m的代数式表示)。
(5)
本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用,滤液沿烧杯壁流下。
(用含m的代数式表示)。
(5)
本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用,滤液沿烧杯壁流下。

【考点】
氧化还原反应;
蒸馏与分馏;
能力提升
真题演练


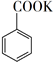 + MnO2
+ MnO2  +HCl→
+HCl→  +KCl
+KCl