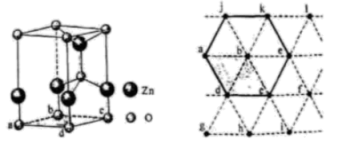
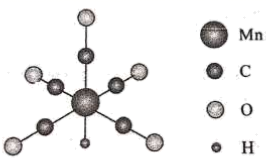
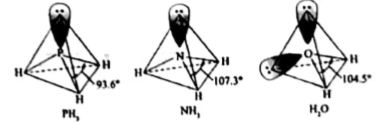
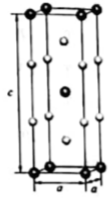
1.
 的有效利用可减缓能源问题。回答下列问题:
的有效利用可减缓能源问题。回答下列问题:
(1)
由合成气(组成为 、CO和少量的
、CO和少量的 )直接制备甲醇,其中的主要过程包括以下三个反应:
(2)
CO可与许多金属(如Ni、Fe等)形成配合物,配位原子是。
(3)
t℃、100kPa条件下,将1mol
)直接制备甲醇,其中的主要过程包括以下三个反应:
(2)
CO可与许多金属(如Ni、Fe等)形成配合物,配位原子是。
(3)
t℃、100kPa条件下,将1mol  和3mol
和3mol  投入含6mol Ar的恒压密闭容器中发生反应,反应10min达到平衡,测得容器中CO、
投入含6mol Ar的恒压密闭容器中发生反应,反应10min达到平衡,测得容器中CO、 分别为0.2mol、0.5mol。
分别为0.2mol、0.5mol。
i.
ii.
iii.
则。
经理论计算表明反应i能够自发的温度为 , 而实际生产温度远高于
, 可能的原因是。
①的平衡转化率为,0~10min内
分压的平均变化速率=
, 反应i的平衡常数
[对于反应
,
, x为物质的量分数]。
②研究表明,反应i的速率方程为 , x表示气体的物质的量分数,
为压强平衡常数,k为反应的速率常数且随着温度升高而增大。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图1所示。反应iii的速率方程为
,
, 图2为反应II的速率常数的对数
与温度的倒数
之间的关系。图1中根据速率方程分析
时,v逐渐增大的原因是。图2中直线(填“A”或“B”)表示
与
的关系。

【考点】
配合物的成键情况;
真题演练
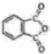 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(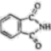 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。