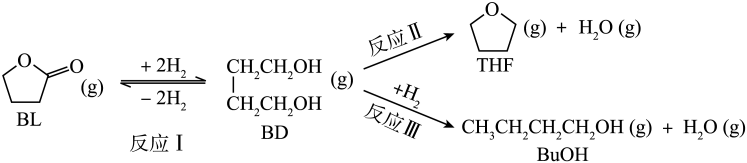
1.
二氧化碳甲烷化技术被认为是 循环再利用最有效的技术之一,也是目前控制
循环再利用最有效的技术之一,也是目前控制 排放的研究热点之一。
排放的研究热点之一。
(1)
 直接加氢生成
直接加氢生成 的机理如图所示:
的机理如图所示:
(2)
向恒压、密闭容器中通入1mol 和4mol
和4mol , 发生的副反应有:
(3)
甲烷燃料电池以能够传导
, 发生的副反应有:
(3)
甲烷燃料电池以能够传导 的固体氧化物为电解质,工作原理如图所示。电池工作时,
的固体氧化物为电解质,工作原理如图所示。电池工作时, 的迁移方向是(填“X→Y”或“Y→X”)。若电极Y上生成CO和
的迁移方向是(填“X→Y”或“Y→X”)。若电极Y上生成CO和 的体积比是1:2,则该电极上的电极反应式是。
的体积比是1:2,则该电极上的电极反应式是。

①在Pd的表面解离为氢原子,需要(填“放出”或“吸收”)能量。
②已知:
化学键 | C-H | O-H | H-H | C=O |
键能/( | 413 | 463 | 436 | 745 |
该过程总反应的热化学方程式为。
ⅰ.
ⅱ.
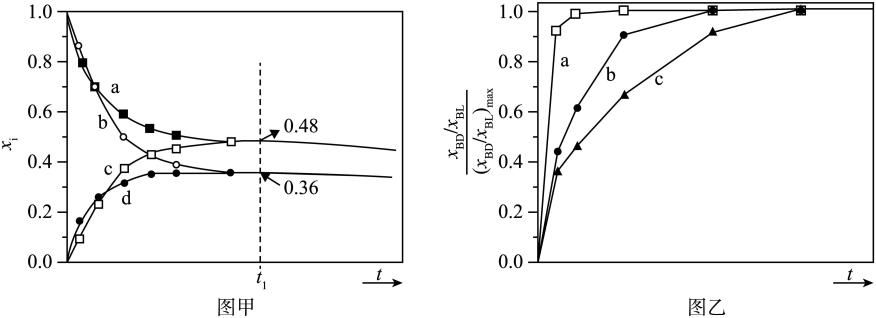
①反应ⅰ和反应ⅱ的lgK(K为平衡常数)随温度T的变化如图所示,则(填“>”或“<”)

②平衡时、CO、
的物质的量随温度的变化如图所示。图中曲线C代表的是。在600℃时,平衡体系中
=mol,副反应ⅰ的压强平衡常数
。(用计算式表示,分压=物质的量分数×总压)


【考点】
反应热和焓变;