1.
硫铁矿(主要成分为 )在硫酸工业中应用广泛,现以硫铁矿烧渣(主要成分为
)在硫酸工业中应用广泛,现以硫铁矿烧渣(主要成分为 、
、 , 还含有少量
, 还含有少量 杂质)为原料,氨水为沉淀剂制备硫酸亚铁晶体的实验流程如下:
杂质)为原料,氨水为沉淀剂制备硫酸亚铁晶体的实验流程如下:

(1)
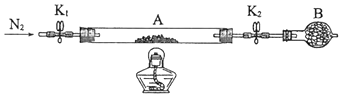
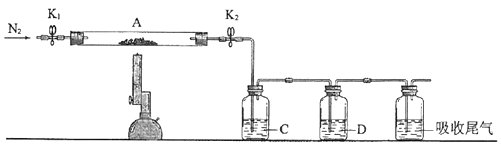
“焙烧”时,鼓入过量的空气的目的是。“操作1”的名称为。
(2)
加入 的目的是;需要控制温度35℃~38℃,原因是。
(3)
加入氨水沉淀时,调节
的目的是;需要控制温度35℃~38℃,原因是。
(3)
加入氨水沉淀时,调节 可使Fe3+沉淀而Al3+不沉淀,滤液2中主要成分为(填化学式)。
(4)
“还原”时,发生的主要反应的离子方程式为;检验Fe3+是否完全转化的实验方法是。
(5)
固定其他条件不变,铁粉过量系数
可使Fe3+沉淀而Al3+不沉淀,滤液2中主要成分为(填化学式)。
(4)
“还原”时,发生的主要反应的离子方程式为;检验Fe3+是否完全转化的实验方法是。
(5)
固定其他条件不变,铁粉过量系数 对酸浸后滤液中Fe3+还原率的影响如图所示。若取加硫酸后的溶液
对酸浸后滤液中Fe3+还原率的影响如图所示。若取加硫酸后的溶液 [其中
[其中 ]制备
]制备 晶体,则向滤液中加入铁粉的质量为
晶体,则向滤液中加入铁粉的质量为 。
(6)
准确称取
。
(6)
准确称取 硫酸亚铁晶体,加水完全溶解,滴加
硫酸亚铁晶体,加水完全溶解,滴加 酸性
酸性 溶液恰好完全反应,消耗酸性
溶液恰好完全反应,消耗酸性 溶液
溶液 。则硫酸亚铁晶体中
。则硫酸亚铁晶体中 的质量分数(写出计算过程,结果保留小数点后两位)。【已知:Fe2++MnO
的质量分数(写出计算过程,结果保留小数点后两位)。【已知:Fe2++MnO +H+=Fe3++Mn2++H2O(未配平)】
+H+=Fe3++Mn2++H2O(未配平)】

【考点】
铁盐和亚铁盐的相互转变;
二价铁离子和三价铁离子的检验;
能力提升
真题演练