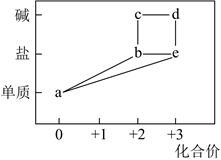
1.
硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要的铁盐,用铁矿石(主要成分为Fe2O3 , 还含有少量的FeO、Al2O3、SiO2、有机杂质)制备硫酸铁铵的流程如下。

回答下列问题:
(1)
灼烧的主要目的是。
(2)
为了提高“酸浸”反应速率,可采取的措施有(写出1点即可)。
(3)
设计实验验证“酸浸”后的浸出液中含有Fe2+(写出必要的试剂、操作过程及实验现象)。
(4)
滤渣X的主要成分的用途有(写出1种即可)。
(5)
浸出液中加入H2O2溶液发生反应的离子方程式为。
(6)
“操作I”包括、过滤、洗涤、干燥。
(7)
采用热重分析法测定硫酸铁铵晶体样品中所含结晶水数目,将样品加热到260℃时,失掉3个结晶水,失重11.18%。硫酸铁铵晶体的化学式为(x值取整数)。
【考点】
铁盐和亚铁盐的相互转变;
能力提升
真题演练