1.
下列关于分离提纯的说法正确的是
A.
超分子“杯酚”具有分子识别的特性,利用此特性可分离 和
和 B.
除去乙炔中混有少量的
B.
除去乙炔中混有少量的 :通过酸性
:通过酸性 溶液,洗气
C.
可用乙醇将碘水中的碘萃取出来
D.
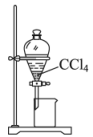
分液操作时,上下层液体依次从下口放出
溶液,洗气
C.
可用乙醇将碘水中的碘萃取出来
D.
分液操作时,上下层液体依次从下口放出
【考点】
分液和萃取;
基础巩固
能力提升
变式训练
拓展培优
真题演练