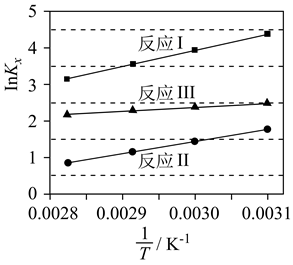
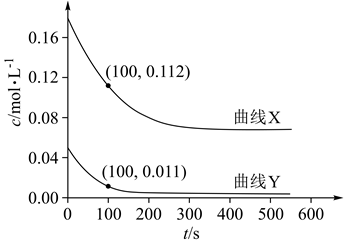
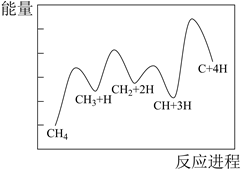
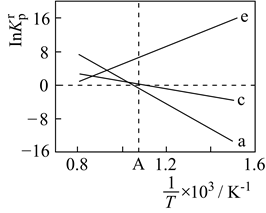
1.
尿素[CO(NH2)2]在医学、农业、工业以及环保领域都有着广泛的应用。工业合成尿素的热化学方程式为:2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(l) ∆H=-87.0kJ•mol-1。合成尿素的反应分步进行,如图是反应的机理及能量变化(单位:kJ•mol-1),TS表示过渡态。
CO(NH2)2(g)+H2O(l) ∆H=-87.0kJ•mol-1。合成尿素的反应分步进行,如图是反应的机理及能量变化(单位:kJ•mol-1),TS表示过渡态。

回答下列问题:
(1)
若∆E1=66.5kJ•mol-1 , 则∆E2=kJ•mol-1。
(2)
若向某恒温、恒容的密闭容器中分别加入等物质的量的NH3和CO2 , 发生合成尿素的反应。下列叙述能说明反应已经达到平衡状态的是(填标号)。
(3)
最后一步反应的化学方程式可表示为:HNCO(g)+NH3(g) CO(NH2)2(g)。
CO(NH2)2(g)。
a.断裂6molN-H键的同时断裂2molO-H键
b.混合气体的压强不再变化
c.混合气体的密度不再变化
d.CO2的体积分数不再变化
I.在T1℃和T2℃时,向恒容密闭容器中投入等物质的量的HNCO和NH3 , 平衡时lgp(NH3)与lgp[CO(NH2)2]的关系如图I所示,p为物质的分压(单位为kPa)。

①T1T2(填“>”“<”或“=”)。
②T2时,该反应的标准平衡常数Kθ=。
[已知:分压=总压×该组分物质的量分数,对于反应:dD(g)+eE(g)gG(g),Kθ=
, 其中Kθ=100kPa,p(G)、p(D)、p(E)为各组分的平衡分压。]
③保持温度不变,点A时继续投入等物质的量的两种反应物,再次达到平衡时,CO(NH2)2的体积分数将(填“增大”“减小”或“不变”)。
Ⅱ.其他条件相同,在不同催化剂下发生该反应,反应正向进行至相同时间,容器中CO(NH2)2的物质的量随温度变化的曲线如图Ⅱ所示。

④在500℃时,催化效率最好的是催化剂(填标号)。
⑤500℃以上,n[CO(NH2)2]下降的原因可能是(不考虑物质的稳定性)。
【考点】
化学平衡常数;
化学反应速率与化学平衡的综合应用;
能力提升
真题演练







 △H1
△H1 △H2
△H2