1.
研究CO2资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。
(1)
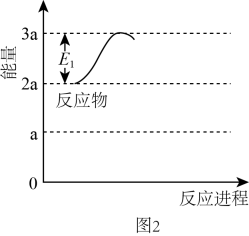
已知:
(2)
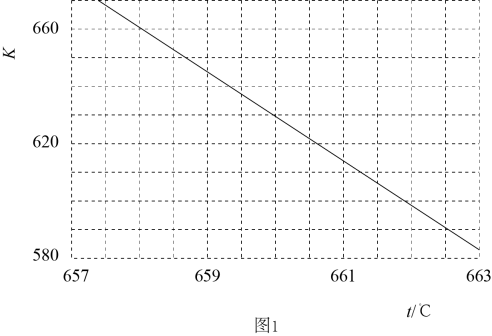
CO2在Cu—ZnO催化下,同时发生反应Ⅰ、Ⅲ;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2;起始及达到平衡时(t min时恰好达到平衡);容器内各气体物质的量及总压强如下表:
(3)
CO2催化加氢制甲烷涉及的反应主要有:
Ⅰ.
Ⅱ.
Ⅲ.
①
②一定条件下,向体积为2L的恒容密闭容器中通入1molCO2和3molH2 , 发生上述反应,达到平衡时,容器中CH3OH(g)的物质的量为0.5mol;CO的物质的量为0.3mol;此时H2O(g)的浓度为mol·L-1。
物质的量/mol | 总压强/kPa | |||||
CO2 | H2 | CH3OH(g) | CO | H2O(g) | ||
起始 | 0.5 | 0.9 | 0 | 0 | 0 | p0 |
平衡 | n | 0.3 | p | |||
若反应Ⅰ、Ⅲ均达到平衡时,p0=1.4p;则表中n=;0~t min内,CO2的分压变化率为kPa·min-¹;反应Ⅰ的平衡常数Kp=(kPa)-2(用含p的式子表示)。
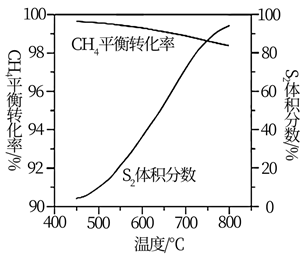
主反应:
副反应:
若将CO2和H2按体积比为1∶4混合(n总=5mol);匀速通入装有催化剂的反应容器中,发生反应(包括主反应和副反应)。反应相同时间,CO2转化率、CH4和CO选择性随温度变化的曲线分别如图所示。

①a点的正反应速率和逆反应速率的大小关系为v正(a)(填“>”、“=”或“<”)v逆(a)。
②催化剂在较低温度时主要选择(填“主反应”或“副反应”)。
③350~400℃;CO2转化率呈现减小的变化趋势,其原因是。
【考点】
化学反应速率与化学平衡的综合应用;
能力提升
真题演练