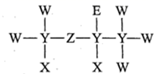1.
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。

(1)
请在上面虚线框中画出元素周期表的上方的轮廓。
(2)
在周期表对应位置写出前五周期中碱金属和卤族元素的元素符号。
(3)
硫元素在周期表中的位置是。结合原子结构解释硫和氯元素的非金属性强弱。下列说法中能比较硫和氯元素的非金属性强弱有(填序号)。
(4)
元素①和元素②形成原子个数比为1∶1的化合物的电子式为。在由元素①②③中两种或三种元素组成的化合物中,属于离子化合物的有 、,请用电子式表示
、,请用电子式表示 的形成过程。
(5)
前20号元素X的最高价氧化物0.112g,溶于水制得对应碱的质量为0.148g。已知X原子核内含有20个中子,通过计算确定元素X为(填元素符号)。
的形成过程。
(5)
前20号元素X的最高价氧化物0.112g,溶于水制得对应碱的质量为0.148g。已知X原子核内含有20个中子,通过计算确定元素X为(填元素符号)。
a.HCl的溶解度比大
b.HCl的酸性比强
c.HCl的稳定性比大
d.还原性:
e.HClO的酸性比弱
f.与铁反应生成
, 而S与铁反应生成FeS
g.能与
反应生成S
【考点】
元素周期表中原子结构与元素性质的递变规律;
元素周期律和元素周期表的综合应用;
能力提升
真题演练