1.
 、
、 经干气重整(DRM)的产物
经干气重整(DRM)的产物 、CO(合成气)可用于合成清洁液体燃料,具有高效利用
、CO(合成气)可用于合成清洁液体燃料,具有高效利用 资源与保护环境的双重效益。DRM主要反应为:
资源与保护环境的双重效益。DRM主要反应为:
Ⅰ. ,
该过程中还可能发生一系列反应,如:
Ⅱ. ,
Ⅲ. ,
Ⅳ. ,
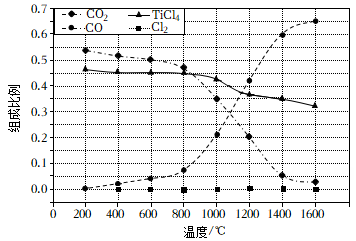
设定压强0.1 MPa下,初始投料、
各1 mol,经热力学计算得到其平衡状态数据如图1示:

(1)
分析在200℃之前体系物质变化的原因,其总反应的热化学方程式为。
(2)
625℃平衡数据图1,此时焦炭的物质的量为,反应Ⅲ的 MPa(计算结果保留两位有效数字)。
(3)
0.1MPa下,改变初始投料比,平衡时H2的选择性(含氢产物占比)变化如图2,实际工业生产多选择投料比为1∶1,温度800~900℃,分析可能的原因为。
(4)
若合成气直接用于合成烯烃(单烯)类液体燃料,结合图分析,DRM反应时合适的温度条件应调节至约,原因。
(5)
实际生产中发现积碳会使镍基催化剂活性降低直至失活,积碳使催化剂失活的可能原因为,积碳量的多少与生产条件密切相关,结合图1分析,若想实现零积碳,应控制生产条件为。
MPa(计算结果保留两位有效数字)。
(3)
0.1MPa下,改变初始投料比,平衡时H2的选择性(含氢产物占比)变化如图2,实际工业生产多选择投料比为1∶1,温度800~900℃,分析可能的原因为。
(4)
若合成气直接用于合成烯烃(单烯)类液体燃料,结合图分析,DRM反应时合适的温度条件应调节至约,原因。
(5)
实际生产中发现积碳会使镍基催化剂活性降低直至失活,积碳使催化剂失活的可能原因为,积碳量的多少与生产条件密切相关,结合图1分析,若想实现零积碳,应控制生产条件为。

【考点】
盖斯定律及其应用;
化学平衡常数;
能力提升
真题演练






 (g) ∆H1<0
(g) ∆H1<0 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
