1.
硼元素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)
二维硼烯氧化物的部分结构如图所示,其化学式为, 键长
键长 键长(填“
键长(填“ ”“
”“ ”或“
”或“ ”)。
(2)
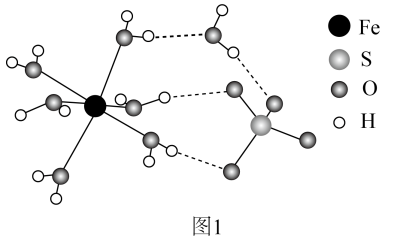
将
”)。
(2)
将 、
、 溶于二乙二醇二甲醚
溶于二乙二醇二甲醚 , 加入四氢呋喃(
, 加入四氢呋喃( )可制得
)可制得 和NaF,则反应的化学方程式为。
和NaF,则反应的化学方程式为。 中
中 键角
键角 中
中 键角(填“
键角(填“ ”“
”“ ”或“
”或“ ”)。
”)。 在水中的溶解度大于其在苯中的溶解度,原因是。
(3)
一定条件下,
在水中的溶解度大于其在苯中的溶解度,原因是。
(3)
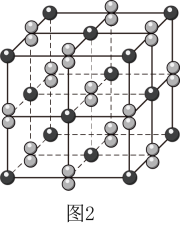
一定条件下, 、
、 、
、 发生非氧化还原反应可制得晶体
发生非氧化还原反应可制得晶体 , 其晶胞结构如图所示(氧原子未画出),晶胞参数
, 其晶胞结构如图所示(氧原子未画出),晶胞参数 ,
,  ,
,  , 若A、D、E三点的原子分数坐标分别为
, 若A、D、E三点的原子分数坐标分别为 、
、 、
、 , 晶胞中D、E间距离为
, 晶胞中D、E间距离为 。设阿伏加德罗常数的值为
。设阿伏加德罗常数的值为 , 该晶体的密度为
, 该晶体的密度为 (用含
(用含 的代数式表示)。
的代数式表示)。


【考点】
键能、键长、键角及其应用;
晶胞的计算;
能力提升
真题演练