1.
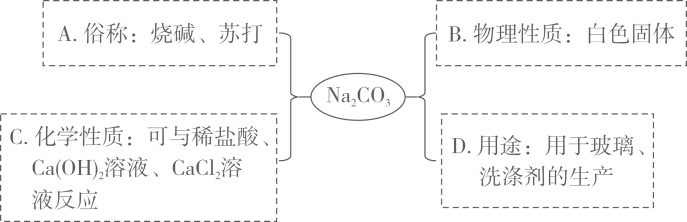
某化学兴趣小组的同学学习了碳酸钠的性质后,小红、小明、小林三位同学分别做了如下实验:

(1)
小红同学向滴有酚酞的碳酸钠溶液中逐滴加入过量的稀盐酸,观察到的现象是。
(2)
小明同学和小林同学分别向盛有少量碳酸钠溶液的试管中滴加氢氧化钙溶液和氯化钙溶液,发现两份溶液都变浑浊,这两个反应的微观实质都是(填微粒符号)结合成白色沉淀。
(3)
三位同学实验后将三支试管中的物质全部倒入同一个烧杯中,发现沉淀全部溶解,且有气泡产生,完全反应后溶液呈无色。他们对此时烧杯中溶液的溶质成分进行了探究:
【查阅资料】CaCl2溶液呈中性。
【提出问题】烧杯中溶液的溶质成分(除酚酞外)有哪些?
【作出猜想】猜想Ⅰ:NaCl、CaCl2 猜想Ⅱ:(填化学式)。
【实验探究】取烧杯中的少量溶液于试管中,向试管中加入,发现的现象是。
【实验结论】猜想Ⅱ成立。
【反思交流】不能将烧杯中的废液直接倒入铸铁下水道,原因是(用化学方程式表示)。
【考点】
常用盐的用途;
盐的化学性质;
能力提升
真题演练