
【任务一】浓硫酸稀释过程中的能量变化。
图1实验中,观察到用石蜡固定在铜片下的乒乓球脱落,此现象说明浓硫酸溶于水(填“放热”或“吸热”)。
【任务二】硫酸的浓度对硫酸化学性质的影响。
图2实验中,观察到很快变黑的是(填“滤纸A”或“滤纸B”),由此可知硫酸的浓度不同,硫酸的腐蚀性不同。
【任务三】稀硫酸的化学性质。
小组同学按图3进行实验,分别将稀硫酸滴加到各个试管中。
(1)试管1中发生反应的化学方程式为。
(2)试管2中可观察到的现象是。
(3)该小组同学利用数字化传感器测得试管3中不断滴加稀硫酸时溶液pH的变化图像如图4所示,硫酸和氢氧化钠恰好完全反应的微观示意图如图5所示。

①图4中a点所示溶液中含有的溶质是(填化学式)。
②该反应的微观实质是。
(4)小组同学对试管4中反应后的溶质成分产生了兴趣,他们继续进行实验。
【提出问题】试管4中反应后的溶液中溶质成分是什么?
【作出猜想】猜想一:可能是K2SO4;
猜想二:可能是(填化学式);
猜想三:可能是K2SO4、H2SO4。
【实验与结论】某同学用洁净干燥的玻璃棒蘸取试管4中反应后的溶液滴到湿润的pH试纸上,测得pH=4,他认为猜想三正确。
【反思与评价】对该同学的操作方法、测量结果及结论进行评价,正确的是(填字母)。
A.方法不正确,结果偏小,结论正确 B.方法正确,结果偏大,结论不正确
C.方法不正确,结果偏大,结论正确 D.方法正确,结果偏小,结论不正确
【任务四】废液回收处理。
实验结束后在老师指导下,同学们将四支试管中的液体倒入废液缸,并对废液缸中的固体物质进行了回收。在检验废液时发现硫酸过量,为防止其污染环境,从实验成本的角度考虑,应向该废液中加入适量的(填物质名称),处理后再排放。
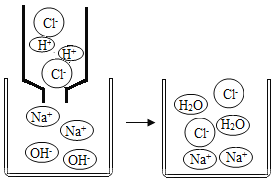
 图2
图2 图3
图3
 图5
图5


 向稀硫酸中滴加过量氢氧化钡溶液
向稀硫酸中滴加过量氢氧化钡溶液 向氢氧化钠溶液中滴加过量稀盐酸
向氢氧化钠溶液中滴加过量稀盐酸 向硝酸银溶液中滴加过量稀盐酸
向硝酸银溶液中滴加过量稀盐酸 向等质量锌片和锌粉中分别加足量且等溶质质量分数的稀硫酸
向等质量锌片和锌粉中分别加足量且等溶质质量分数的稀硫酸




