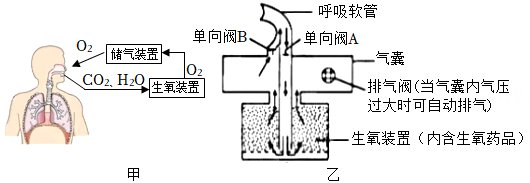
1.
如下是小科在进行研究性学习课题《化学反应中质量守恒的研究》的过程。
【提出问题】氧化汞(HgO)加热时,会生成汞和氧气(常温常压下,氧气密度为)。反应结束后,所生成的汞和氧气的质量总和与参加反应的氧化汞的质量是否相等呢?
【资料信息】⑴氧化汞反应的化学方程式:
⑵测量气体体积需要在标准大气压下测量才是准确数值。
【实验设计及过程】检查装置的气密性后,在试管中加入适量的药品,并测得反应装置、滤毒器与物质总质量为m1。待反应完全后,调整量筒液面至“合适”位置,测出气体体积记为V。再测量反应装置、滤毒器与剩余物质总质量为m2。

(1)
实验时,小科在量筒中加入一些煤油的目的是。
(2)
反应完全后,量筒液面需要调整到的“合适”位置指的是。
(3)
若本实验能正确反应化学变化中的质量守恒,则上述测量结果存在关系式是:。
【考点】
质量守恒定律及其应用;
能力提升
真题演练