1.
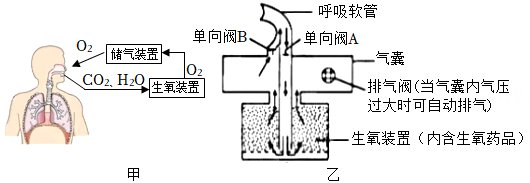
小金设计了一款在缺氧环境或出现高浓度有毒有害气体环境下逃生时使用的自救呼吸器。其设计思路如图甲所示,自救呼吸器的结构如图乙所示(其中箭头方向表示气体流动方向)。

(1)
呼吸气路的设计:自教呼吸器使用时,需用鼻夹夹住鼻子,用嘴咬合呼吸软管进行呼吸。在正常呼气时,单向阀A和B的开闭情况是(选填“A打开,B闭合”或“A闭合,B打开”)。
(2)
生氧药品的选择:小金查阅资料发现超氧化物(用MO2表示,其中M为+1价)可与人呼出气中的CO2、H2O反应生成O2 , 其反应的化学方程式为:
(3)
影响自救呼吸器有效防护时间的因素有(选填序号)。
4MO2+2H2O=4X+3O2↑
4MO2+2CO2=2M2CO3+3O2
X的化学式为。
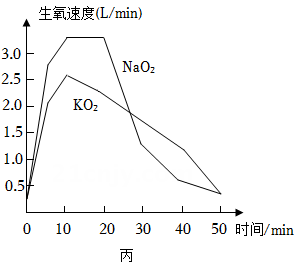
500g超氧化钾(KO2)和500g超氧化钠(NaO2)的生氧性能如图丙所示。小金依据人正常呼吸时需要生氧药品的生氧速度不低于1L/min,并结合自救呼吸器的结构和生氧药品的生氧性能,选取了KO2作为生氧药品。选取KO2的优点是。(写出1点)
①生氧药品的质量 ②外界有毒有害气体浓度
③外界氧气浓度 ④生氧药品的种类
【考点】
大气压强的存在;
质量守恒定律及其应用;
能力提升


